UNIDAD 2
CONTROL DE LAS MICROESTRUCTURAS Y LAS PROPIEDADES DE LOS MATERIALES
CAP I: Diagramas de equilibrio de fases
En termodinámica y ciencia de materiales se denomina diagrama de fase o diagrama de estados de la materia, a la representación entre diferentes estados de la materia, en función de variables elegidas para facilitar el estudio del mismo. Cuando en una de estas representaciones todas las fases corresponden a estados de agregación diferentes se suele denominar diagrama de cambio de estado.
Los diagramas de equilibrio pueden tener diferentes concentraciones de materiales que forma una aleación a distintas temperaturas. Dichas temperaturas van desde la temperatura por encima de la cual un material está en fase líquida hasta la temperatura ambiente y en que generalmente los materiales están en estado sólido.
Diferentes diagramas de equilibrio:
Los diagramas de equilibrio más sencillos son los de presión - temperatura de una sustancia pura, como puede ser el del agua. En el eje de ordenadas se coloca la presión y en el de abscisas la temperatura. Generalmente, para una presión y temperatura dadas, el cuerpo presenta una única fase excepto en las siguientes zonas:
Punto triple: En este punto del diagrama coexisten los estados sólido, líquido y gaseoso. Estos puntos tienen cierto interés, ya que representan un invariante y por lo tanto se pueden utilizar para calibrar termómetros.
Dos metales (A, B) a temperaturas superiores a sus respectivos puntos de fusión (TA, TB) se encuentran en estado líquido pudiéndose disolver y conformar así una fase única líquida. Esto quiere decir que no podemos establecer diferencias de comportamiento u observación entre las distintas partes del líquido y que los metales en las proporciones mezcladas tienen la propiedad de miscibilidad. Si la mezcla líquida, XA + XB, la sometemos a un proceso de solidificación, mediante enfriamiento, llegamos a obtener el producto que se denomina aleación de los metales A y B.
Es conocido que las aleaciones mejoran las características de los metales puros. Realmente debería decirse que introducen variables que diferencian el comportamiento de los metales puros que las componen, porque en algunas circunstancias pueden perjudicar sus propiedades. Obviamente, conformar una aleación es uno de los medios más primitivos que la ingeniería ha dispuesto para actuar sobre las propiedades de los metales puros, incluso históricamente la aleación es predecesora como lo justifica el bronce, Edad del bronce
En ciencia de materiales se utilizan ampliamente los diagramas de fase binarios, mientras que en termodinámica se emplean sobre todo los diagramas de fase de una sustancia pura.
Diagrama de fase de una sustancia pura:
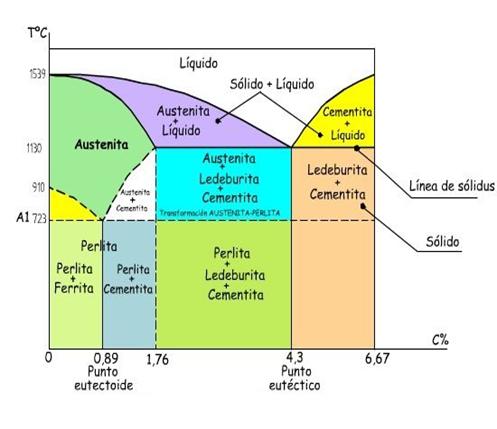
Existen diferentes diagramas según los materiales sean totalmente solubles en estado sólido y líquido o sean miscibles a que sean insolubles. También pueden darse casos particulares. Uno de los diagramas de equilibrio más clásico es el de los aceros que tiene particularidades y donde afecta claramente la concentración y las diferentes cristalizaciones que puede darse en el hierro estando en estado sólido y a diferentes temperaturas.
Los pares (presión, temperatura) que corresponden a una transición de fase entre:
Dos fases sólidas: Cambio alotrópico;
Entre una fase sólida y una fase líquida: fusión - solidificación;
Entre una fase sólida y una fase vapor (gas): sublimación - deposición (o sublimación inversa);
Entre una fase líquida y una fase vapor: vaporización - condensación (o licuefacción).
Es importante señalar que la curva que separa las fases vapor-líquido se detiene en un punto llamado punto crítico (La densidad del líquido y vapor son iguales). Más allá de este punto, la materia se presenta como un fluido supercrítico que tiene propiedades tanto de los líquidos como de los gases. Modificando la presión y temperatura en valores alrededor del punto crítico se producen reacciones que pueden tener interés industrial, como por ejemplo las utilizadas para obtener café descafeinado.
Es preciso anotar que, en el diagrama P-T del agua, la línea que separa los estados líquido y sólido tiene pendiente negativa, lo cual es algo bastante inusual. Esto quiere decir que aumentando la presión el hielo se funde, y también que la fase sólida tiene menor densidad que la fase líquida.
Diagrama de fase binario:
Cuando aparecen varias sustancias, la representación de los cambios de fase puede ser más compleja. Un caso particular, el más sencillo, corresponde a los diagramas de fase binarios. Ahora las variables a tener en cuenta son la temperatura y la concentración, normalmente en masa.
Hay punto y líneas en estos diagramas importantes para su caracterización:
Sólido puro o disolución sólida
Mezcla de disoluciones sólidas (eutéctica, eutectoide, peritéctica, peritectoide)
Mezcla sólido - líquido
Únicamente líquido, ya sea mezcla de líquidos inmiscibles (emulsión)o un líquido completamente homogéneo.
Mezcla líquido - gas
Gas (lo consideraremos siempre homogéneo, trabajando con pocas variaciones da altitud).
En un diagrama binario pueden aparecer las siguientes regiones:
Línea de liquidus, por encima de la cual solo existen fases líquidas.
Línea de solidus, por debajo de la cual solo existen fases sólidas.
Línea eutéctica y eutectoide. Son líneas horizontales (isotermas) en las que tienen lugar transformaciones eutécticas y eutectoides, respectivamente.
Línea de solvus, que indica las temperaturas para las cuales una disolución sólida (α) de A y B deja de ser soluble para transformarse en dos disoluciones sólidas (α) + (β) de distinta composición en A y B.
Concentraciones definidas, en las que tienen lugar transformaciones a temperatura constante:
Eutéctica
Eutectoide
Peritéctica
Peritectoide
Monotéctica
Monotectoide
Sintéctica
Catatéctica
Sustancias puras:
Llamamos sustancia pura a cualquier material que tiene unas propiedades características que la distinguen claramente de otras. Algunas de estas propiedades son difíciles de medir comocolor, olor, sabor; pero otras se pueden determinar con exactitud, por ejemplo ladensidad o las temperaturas de fusión y ebullición en unas condiciones dadas. Como ejemplo, el agua pura obtenida en la investigación inicial sería transparente, sin olor ni sabor. Además, su densidad sería 1 g/ml a la temperatura de 15ºC, su temperatura de fusión 0ºC y la ebullición se produciría a 100ºC (todo ello a la presión de una atmósfera).
A veces no es fácil afirmar si una sustancia es pura o no. Realiza el ejercicio adjunto para comprobarlo.
Tampoco debemos confundir sustancia pura y sustancia simple. Algunas sustancias puras son simples (se denominan elementos), pero otras, que llamamos compuestos, se pueden descomponer en elementos.
Solución solida:
Una solución sólida es una solución en estado sólido de uno o más solutos en un disolvente.
El soluto puede incorporarse dentro de la estructura cristalina del disolvente bien mediante sustitución, reemplazando cada átomo del disolvente por un átomo del soluto (y formará una solución sólida sustitucional), o bien de forma intersticial, encajándose los átomos de soluto dentro del espacio que hay entre los átomos del disolvente. Ambos tipos de solución sólida afectan a las propiedades del material ya que distorsionan, aunque sea poco, la estructura cristalina y porque perturban la homogeneidad física y eléctrica del material disolvente.
Una solución sólida es una solución en estado sólido de uno o más solutos en un disolvente.
El soluto puede incorporarse dentro de la estructura cristalina del disolvente bien mediante sustitución, reemplazando cada átomo del disolvente por un átomo del soluto (y formará una solución sólida sustitucional), o bien de forma intersticial, encajándose los átomos de soluto dentro del espacio que hay entre los átomos del disolvente. Ambos tipos de solución sólida afectan a las propiedades del material ya que distorsionan, aunque sea poco, la estructura cristalina y porque perturban la homogeneidad física y eléctrica del material disolvente.
Tipos:
Existen 2 tipos de soluciones sólidas:
Sustitucional: El átomo o ion del soluto, ocupa el lugar de los átomos o iones del solvente
Intersticial:El átomo o ion del soluto se coloca en el intersticio de la celda unitaria del solvente.
Existen 2 tipos de soluciones sólidas:
Sustitucional: El átomo o ion del soluto, ocupa el lugar de los átomos o iones del solvente
Intersticial:El átomo o ion del soluto se coloca en el intersticio de la celda unitaria del solvente.

Diagramas Binarios:
La constitución de una aleación queda descrita por:
• La composición global de la aleación
• El número de fases presentes
• La composición de cada fase
• La fracción, porcentaje o proporción en peso de cada fa