UNIDAD 1
CAPITULO III
ORGANIZACIÓN ATÓMICA
CELDAS UNITARIAS:
La estructura atómica influye en la forma en que los átomos se unen entre sí; esto además nos ayuda a comprender la clasificación de los materiales como metales, semiconductores, cerámicos y polímeros y nos permite llegar a ciertas conclusiones generales referentes a propiedades mecánicas y comportamiento físico de estas cuatro clases de materiales. La estructura electrónica del átomo, que queda descrita por cuatro números cuánticos ayuda a determinar la naturaleza de los enlaces atómicos y las propiedades físicas y mecánicas de los materiales.
a) Enlace metálico: encontrado en los metales, los electrones de valencia se mueven con facilidad, en consecuencia, los metales son dúctiles y tienen alta conductividad eléctrica y térmica.
b) El enlace covalente se encuentra en muchos materiales cerámicos, semiconductores y polímeros. Requiere que los átomos compartan electrones de valencia, los enlaces son fuertes y altamente direccionales, haciendo que estos materiales sean frágiles y tengan baja conductividad eléctrica y térmica.
c) El enlace iónico encontrado en muchos cerámicos se produce cuando un átomo muy electropositivo dona un electrón a otro muy electronegativo generando un anión y un catión que se unen electrostáticamente. Al igual que los materiales enlazados covalentemente, estos tienden a ser frágiles y malos conductores.
d) Fuerzas de Van der Waals unen principalmente a moléculas que tienen una distribución desigual de cargas o están polarizadas. Son de naturaleza electrostática y se encuentran en polímeros termoplásticos.
La energía de unión está relacionada con la fuerza de los enlaces y es alta en materiales unidos en forma iónica o covalente. Los materiales con energía de unión alta normalmente tienen:
• Alta temperatura de fusión
• Alto módulo de elasticidad
• Bajo coeficiente de expansión térmica.
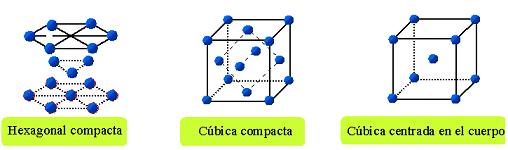
Existen 14 tipos de celdas unitarias contenidas en siete estructuras cristalinas o redes de
Bravais.
Los puntos reticulares se sitúan en las esquinas de la celda y en algunos casos en los centros de
las caras o en el centro de la misma celda. Una celda unitaria queda denotada completamente
por los parámetros reticulares
.
Los parámetros reticulares definen el tamaño y la forma de una celda unitaria. Estos incluyen
las dimensiones de los lados de la celda y el ángulo entre ellos

ESTRUCTURA CRISTALINA:

ESTRUCTURA CRISTALINA:
El arreglo de los átomos juega un papel importante en la microestructura, comportamiento y
propiedades de un material sólido.
En los metales, algunas disposiciones atómicas permiten una excepcional ductilidad, mientras
que otras una gran resistencia.
Algunas propiedades físicas de las cerámicas dependen de el arreglo atómico.
Los transductores usados para producir una señal eléctrica en un estéreo deben a su estructura
cristalina la capacidad de producir caídas de carga permanente en el material.
Los diferentes comportamientos exhibidos por los polímeros como: gomas, plásticos y resinas
epóxicas dependen de las diferencias en los arreglos atómicos.
TRANSFORMACIONES ALOTRÓPICAS O POLIMORFICAS :
Los materiales que pueden tener más de una estructura cristalina se llaman alotrópicos o
polimórficos. El término alotropía se reserva para este comportamiento en elementos puros,
mientras que polimorfismo es más general. En la tabla se ve como el hierro y el titanio pueden
tener más de una estructura cristalina; a bajas temperaturas el hierro es BCC pero a
temperaturas más altas se convierte en FCC.
Muchos cerámicos como el SiO2 son polimórficos. La transformación puede venir
acompañada de un cambio de volumen durante el calentamiento o enfriamiento. De no estar
controlada correctamente, este cambio hará que el material se agriete y falle.
CRISTALES IONICOS:
El cristal está formado por iones positivos y negativos unidos entre si mediante fuerzas de naturaleza electrostática
Hay que decir que este tipo de cristal son malos conductores del calor y de la electricidad ya que carecen de electrones libres. Pero cuando el cristal es sometido a una temperatura elevada los iones adquieren movilidad y aumenta su conductividad eléctrica.
CRISTALES COVALENTES:
Los átomos de los cristales covalentes se mantienen unidos en una red tridimensional únicamente por enlaces covalentes. Esté tipo de cristal son extremadamente duros y difíciles de deformar, y son malos conductores del calor y por lo tanto de la electricidad (ya que sabemos que el calor y la conductividad tienen una relación directa) ya que no existen electrones libres que trasladen energía de un punto a otro. Un ejemplo típico de este tipo de cristal es el Diamante.
CRISTALES MOLECULARES:
Son sustancias cuyas moléculas son no polares, la característica fundamental de este tipo de cristal es que las moléculas están unidas por las denominadas fuerzas de Van der Waals; estas fuerzas son muy débiles y correspondes a fuerzas de dipolos eléctricos.
Su conductividad es nula; es decir no son conductores ni del calor y la electricidad y son bastante deformables.
CRISTALES METALICOS:
La estructura de los cristales metálicos es más simple porque cada punto reticular del cristal está ocupado por un átomo del mismo metal.
Se caracterizan por tener pocos electrones débilmente ligados a sus capas más externas. Están cargados positivamente.
Su conductividad es Excelente tanto térmica como eléctrica debido a sus electrones libres.

DIFRACCIÓN DE RAYOS X :
No hay comentarios.:
Publicar un comentario